pH-Wert
Defintion pH-Wert
Der pH-Wert ist ein Maß für den sauren oder alkalischen Charakter einer Lösung. Er beeinflusst viele chemische und biologische Prozesse. „pH“ ist vom lateinischen pondus hydrogenii (Gewicht des Wasserstoffs) oder auch vom lateinischen potentia hydrogenii (Wirksamkeit des Wasserstoffs) hergeleitet und ist die wohl häufigste Messgröße in der Analytik.
Der pH-Wert wird im Allgemeinen auf einer numerischen Skala von 0-14 angegeben. Hierbei steht der Wert 7 für Neutralität. Die Zahlen auf der Skala nehmen mit zunehmender Alkalität zu, während die Zahlen auf der Skala mit zunehmendem Säuregehalt abnehmen.
Jede Einheit der Veränderung entspricht einer zehnfachen Veränderung des Säure- oder Alkaligehalts. Der pH-Wert ist auch gleich dem negativen Logarithmus der Wasserstoffionenkonzentration oder der Wasserstoffionenaktivität.
Der pH-Wert hat eine herausragende Bedeutung in der Wasser- und Umweltanalytik, so wie in nahezu allen Bereichen der Industrie. Ob in einer Molkerei die Qualität eines Käses stimmt, das Wasser in einer Trinkwasserversorgung Korrosionsschäden verursacht oder die Fällung in einer Aufbereitungsanlage für Galvanikabwässer Schwermetallionen optimal erfolgt, hängt u. a. vom pH-Wert ab.
Beim pH-Wert geht es also um Wasserstoff oder genauer um Wasserstoffionen. In wässrigen Lösungen entstehen Wasserstoffionen bei der Dissoziation von Säure- oder Wassermolekülen. Reines Wasser dissoziiert als Wasserstoffionen (H+) und Hydroxidionen (OH-).
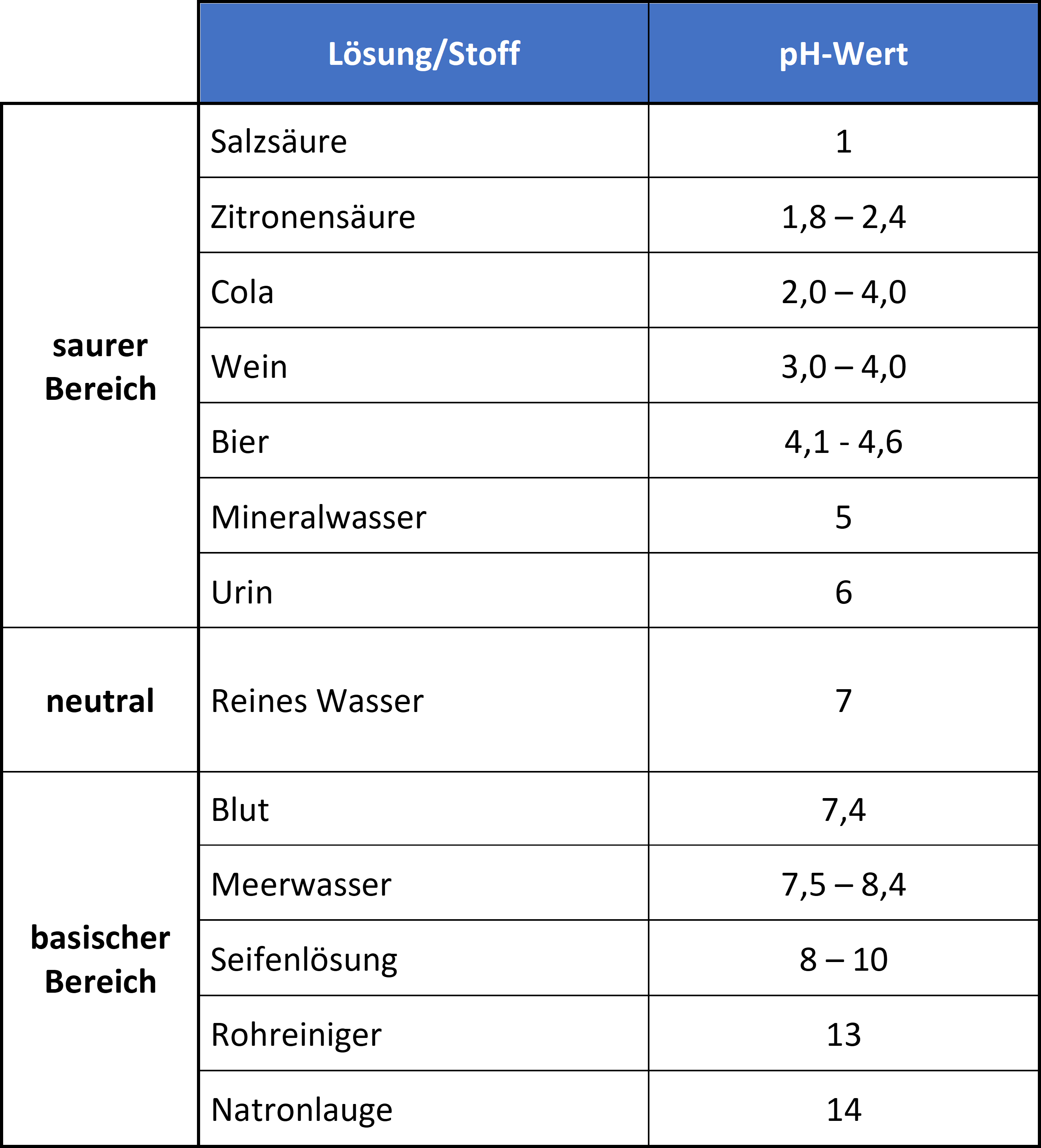
Sauer sind Lösungen mit einen pH-Wert kleiner als 7. Sie enthalten demzufolge mehr Wasserstoffionen als Hydroxidionen. Neutral sind Lösungen mit einem pH-Wert von 7 und enthalten gleiche Mengen Wasserstoff- und Hydroxidionen (der genaue Neutralpunkt hängt von der Temperatur ab). Basisch sind Lösungen mit einen pH-Wert größer als 7 und beinhalten weniger Wasserstoffionen als Hydroxidionen.
Es gibt die verschiedensten Möglichkeiten den pH-Wert zu messen: kolorimetrisch, photometrisch oder elektrochemisch. Verschiedene Messverfahren können zu unterschiedlichen Messergebnissen führen, die im Prinzip alle richtig sind. Damit aus dieser Tatsache keine Verwirrung entsteht, ist in der nationalen und internationalen Normung festgelegt, dass der pH-Wert elektrochemisch mit einer Glaselektroden-Messkette gemessen wird.
Der Sensor für die Messung ist die pH-Messkette. Sie besteht aus zwei elektrochemischen Halbelementen, welche auch als Mess- und Bezugselektrode bezeichnet werden. An der Messelektrode bilden die Wasserstoffionen ein vom pH-Wert der Messlösung abhängiges Potenzial. Das Potenzial der Bezugselektrode bleibt vom pH-Wert unabhängig und ist konstant. Die Differenz zwischen den beiden Potenzialen bestimmt das elektrische Signal des Sensors, die sogenannte Messkettenspannung. Hieraus ergibt sich dann der pH-Wert.
Die Glaselektrode ist der leistungsfähigste Sensor für die pH-Messung. Ihr Arbeitsbereich deckt praktisch den gesamten pH-Bereich ab. Lediglich für stark alkalische Lösungen sind spezielle Membrangläser notwendig. Die Glaselektrode ist von guter Beständigkeit. Die pH-Messketten können mehrere Jahre halten und sind in den meisten Messmedien verwendbar.
Der pH-sensitive Teil der Einstabmesskette besteht aus speziellen Glasmischungen. Für verschiedene Anwendungsgebiete gibt es unterschiedliche Glassorten. Da Membranglas egal welcher Sorte „durchsichtig“ ist, färben die Hersteller die Gläser mit unbedenklichen Zusätzen zur besseren Unterscheidung ein.
Die Bezugselektrode ergänzt die pH-Elektroden zur Messkette. Ihre Bauform und ihr Zustand beeinflusst wesentlich die Zuverlässigkeit der Messwerte und den erforderlichen Wartungsaufwand. Am weitesten verbreitet ist die Silber-/Silberchlorid-Elektrode (Ag/AgCl). Diese Bezugselektrode hat sich für die meisten Anwendungen gut bewährt und durchgesetzt. Nicht oder nicht mehr so häufig werden z. B. Kalomel-, Kupfer/Kupferiodid- und Thalamid-Bezugselektroden verwendet.



Die elektrische Verbindung zur Messlösung kann z. B. ein für den Elektrolyten durchlässiges Diaphragma herstellen. Elektrolytionen gelangen über das Diaphragma in die Messlösung und sorgen damit für den Ladungstransport. Je durchlässiger ein Diaphragma ist, desto zuverlässiger funktioniert der Ladungstransport und umso stabiler ist das Potenzial der Bezugselektrode. Der erhöhte Elektrolytverbrauch vermindert allerdings auch die Standzeit des Elektrolyten. Je durchlässiger ein Diaphragma ist, umso eher können auch Chemikalien und Stoffe in die Bezugselektrode selbst eindringen und dort chemische Reaktionen auslösen. Dies kann zum Ausfall der Elektrode führen. Die richtige Auswahl des Diaphragmas für die jeweilige Applikation ist deshalb sehr wichtig, um die Standzeit des Sensors zu maximieren.
Der Begriff Messeinrichtung umfasst die komplette, zur pH-Messung verwendete Geräteausstattung, bestehend aus:
- pH-Geber: pH- und Bezugselektrode oder pH-Einstabmesskette
- Eintauch- oder Durchflussarmatur
- abgeschirmtes Messkabel
- Messumformer/Regler (mV-Meter)
Der Elektrolyt und das Diaphragma müssen je nach Anwendung aufeinander abgestimmt sein. Für stark verschmutzende Flüssigkeiten, wie Abwasser, Suspensionen oder Emulsionen, sind verschmutzungsunempfindliche Diaphragmen erforderlich, z. B. Ringspalt oder Schliff. Ein verfestigter Elektrolyt, Gel- oder Polymerisat mindert den Elektrolytausfluss und somit den Wartungsaufwand.
Für optisch reine Wässer, wie Schwimmbecken- und Trinkwasser, sind Elektrolytlösungen besser geeignet. Aufgrund der geringeren Viskosität sind hier feinporigere Diaphragmen, z.B. Keramik- oder Glasfaserdiaphragmen, notwendig.
Für viele Anwendungen darf der Elektrolyt keine oder möglichst wenig Silberionen enthalten. Sulfit haltige Lösungen und salzarme Wässer, bilden schwerlösliche Silberverbindungen im Diaphragma und können zu einer Störung der pH-Messung führen.
Um eine einwandfreie Übertragung des Messsignals zu erhalten, werden in der pH-Messtechnik nur spezielle Koaxialleitungen verwendet. Sie stellen die elektrische Verbindung zwischen dem Sensor und dem Messumformer her. Die pH-Leitungen weisen einen speziellen Aufbau auf. Zusätzlich zu einer Kupferschirmung ist eine halbleitende Schicht vorhanden. Ungeeignet sind handelsübliche Antennen- oder Computerkabel. Die Kabel dürfen aufgrund der Hochohmigkeit der pH-Messkette nicht über Klemmen geführt werden. Außerdem ist die Kabelleitungslänge wegen der Notwendigkeit der Messkettenkalibrierung möglichst kurz zu halten.
Der Messumformer hat u. a. die Aufgabe, das hochohmige Spannungssignal der pH-Messkette auf die pH-Skala umzurechnen und diese Werte als Anzeige- und/oder Normsignal wieder zur Verfügung zu stellen. Der Messumformer enthält in der Regel eine Kalibrierroutine zur Messkettenjustierung mit Pufferlösungen. Häufig sind die Messumformer auch gleichzeitig als Regler ausgeführt, die z. B. die Dosierung von Säuren und Laugen zur pH-Wert-Korrektur durchführen können. Außerdem berücksichtigen die Messumformer die Medientemperatur, entweder durch manuelle Eingabemöglichkeiten oder durch einen eigenen Messeingang für den Temperatursensor.
Elektrochemische Sensoren sind empfindliche Messgeräte. Um diese zum einen optimal in den Prozess einbinden zu können und zum anderen vor mechanischer Beschädigung zu schützen, ist der Einsatz von entsprechenden Armaturen notwendig. Durch optionale Zubehörteile wird zudem verhindert, dass die Sensoren bei abgelassenem Tank „trockenstehen“ und der Sensor zerstört wird. Aus diesem Grund dürfen pH-Sensoren niemals „trocken“ gelagert werden.
Nach der Wahl einer optimalen Messeinrichtung muss diese in Betrieb genommen werden. Die Inbetriebnahme umfasst nicht nur die Montage der Messeinrichtung, sondern auch die Wahl des richtigen Messortes. Die Messeinrichtung zeigt jeweils den pH-Wert an, der am Ort der Messung herrscht. Vorgaben für die Wahl des Messortes geben z. B. anwendungsorientierte Normen und Verordnungen, wie die DIN 19643 zur Messung des Schwimmbeckenwassers oder das Merkblatt M 256 der Abwassertechnischen Vereinigung.pH-Messungen gibt es in allen Bereichen der Technik und des Umweltschutzes. Je nach Anwendung findet die Messung im Labor, mit einem Handgerät vor Ort oder kontinuierlich, z. B. im Prozess, statt. Folgende praktische Anwendungsfälle der pH-Messung können beispielhaft genannt werden:
- Abwasserreinigungsanlagen
- Bädern
- Galvanikbetrieben
- Kraftwerken
- Heizungswasser
- Trinkwasserversorgungsanlagen sowie
- Trinkwassertalsperren
- Lebensmittelindustrie
Praktische Anwendungsfälle:
Beim Bierbrauen ist das Ablesen des pH-Werts in jeder Phase des Brauprozesses wichtig. Ein hoher pH-Wert kann zu einem Fehlgeschmack und einer schlechten enzymatischen Umsetzung der Maische führen.
Um bestimmte Schadorganismen zu hemmen ist ein pH-Wert von 4,1-4,6 nötig. Bei einem zu niedrigen pH-Wert geht man von einer Infektion aus, da säurebildende Bakterien vermehrt vorkommen. Ein solches Bier ist sauer und ungenießbar. Um ein Bier mit gleichbleibenden Eigenschaften und Geschmack zu erhalten, muss der Brauer den pH-Wert in jeder Phase des Prozesses überwachen und einhalten.

Einen klassischer Anwendungsfall der pH-Wert Überwachung stellt das Heizungswasser dar. In der VDI 2035-2 wird für den pH-Wert ein Bereich zwischen 8,2 und 9,5 empfohlen, sofern keine Aluminiumwerkstoffe verbaut sind.
In vielen Kreisläufen finden sich häufig Armaturen aus Kupferlegierungen oder Komponenten aus Kupferwerkstoffen. Aus diesem Grund wird durch Fachexperten beispielsweise für Heizungsumwälzwasser bei salzhaltiger Fahrweise ein pH-Wert von 8,3 bis 9,5 empfohlen. Hintergrund dieser Empfehlung ist zum einen, dass ab einem pH-Wert > 8,2 kein Kohlendioxid mehr im Wasser gelöst sein kann. Liegt Kohledioxid in gelöster Form (Kohlensäure) im Wasser vor, können Ablagerungen an Wärmeübergangsflächen in Form von schwer löslichen Eisencarbonat (FeCO3, auch „Eisenspat“ genannt) entstehen. Im Ergebnis dieser Ablagerungen kann es zu Rissbildungen kommen. Weiterhin haben Untersuchungen gezeigt, dass der Kupferabtrag ab einem pH-Wert > 9,5 deutlich zunimmt. Dies führt zur oberen Grenze des benannten Bereiches für den empfohlenen pH-Wert.
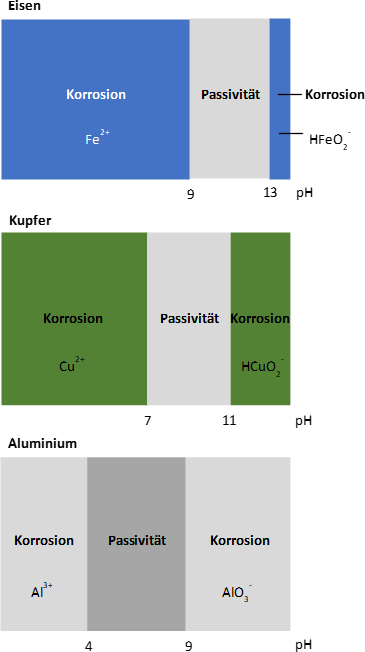
Bei Verwendung von Eisen ist der pH-Bereich zwischen 9 und 13 anzustreben. Innerhalb dieses Bereiches bilden sich feste Korrosionsprodukte an der Oberfläche, welche eine Schutzwirkung ausüben können. Für Kupfer gilt, dass ein pH-Wert > 7 akzeptabel ist, dieser jedoch den Wert 11 nicht überschreiten darf, da es ab hier wieder merklich in Lösung geht. Sofern Ammonium Bestandteil des Wassers ist, beginnt dieser Prozess bereits ab einem pH-Wert von 9,5.
Befinden sich Elemente aus Aluminium im Kreislauf, muss der pH-Wert auf 8,5 begrenzt werden. Aluminium zeigt sich bei pH-Werten zwischen 4 und < 9 passiv. Oberhalb von pH 9 geht das Metall unter Wasserstoffentwicklung, selbst in vollkommen sauerstoffdichten/ geschlossenen Systemen.
Somit gilt für Systeme die Aluminiumbauteile enthalten, dass der pH-Wert ohne Kohlendioxid im System > 8,2 und ansonsten nicht > 8,5 (max. 9,0) sein darf.
Einen weiteren Anwendungsbereich stellt der Einsatz von verzinkten Rohrbündeln (typisch beim Einsatz von Ammoniakkälteanlagen) dar. Verzinkte Oberflächen haben direkt nach der Produktion noch keine Schutzschicht gebildet. Die Zinkschicht ist sehr empfindlich gegenüber höheren pH-Werten und darf daher in den ersten sechs bis zwölf Wochen nach der Inbetriebnahme nicht über 8,3 liegen. Bei höheren pH-Werten innerhalb dieser Zeit besteht die Gefahr der Entzinkung. Der Wert darf auf 8,8 angehoben werden, wenn sich die matte Zinkoxidschicht gebildet hat.
Zusammenfassend lässt sich festhalten, dass der pH-Wert eine charakteristische Größe sowohl für die Herstellung von Produkten, als auch für den fachgerechten Anlagenbau und den kontinuierlichen Betrieb solcher Anlagen darstellt.
